Profilaxia pré-exposição para HIV com antiviral injetável pode chegar à rede pública em breve
 O controle mais eficiente e seguro da carga viral em pessoas que vivem com HIV e a prevenção farmacológica da infecção pelo vírus foram trunfos importantes no controle do HIV ao longo dos anos (para mais detalhes, veja nossa postagem anterior).
O controle mais eficiente e seguro da carga viral em pessoas que vivem com HIV e a prevenção farmacológica da infecção pelo vírus foram trunfos importantes no controle do HIV ao longo dos anos (para mais detalhes, veja nossa postagem anterior).
Um novo capítulo nesse percurso foi a aprovação recente de um antiviral injetável de longa duração pelo FDA, nos EUA. A principal vantagem com o uso de antivirais perenterais é a adesão melhorada ao tratamento e comodidade. Uma única injeção intramuscular poderia manter uma pessoa “medicada” por até 2 meses, ao invés dos comprimidos diários.
Cabotegravir como nova opção com perfil farmacocinético favorável
O cabotegravir (GSK1265744) tem ação anti-HIV por inibir a integrase viral, enzima necessária para a integração do genoma viral ao DNA humano. Como essa etapa é anterior à replicação viral, o fármaco impede o estabelecimento da infecção celular. Esse mecanismo é importante para reduzir a carga viral em pessoas com HIV e impedir a replicação viral inicial em pessoas sem o vírus. Por isso, o fármaco parece bastante versátil em estratégias diversas de combate ao HIV.
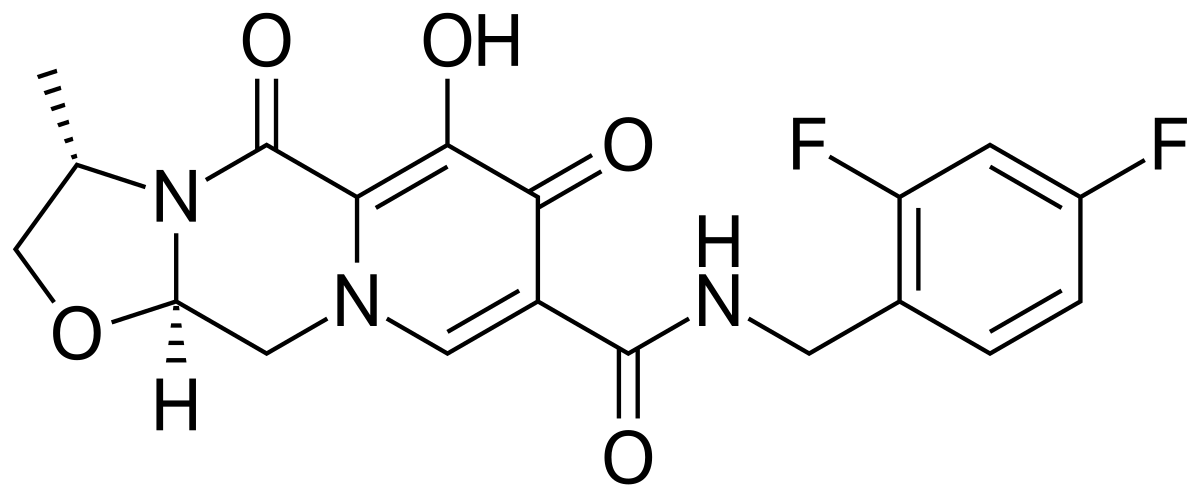
Cabotegravir (GSK1265744). Fonte: PubChem.
O fármaco pode ser administrado por via oral (Vocabria®), em regime de uso diário. Ele também está disponível como suspensão para uso injetável, que permite a liberação controlada do fármaco ao longo de algumas semanas. Com o uso intramuscular, o fármaco pode ser adotado isoladamente (Vocabria® ou Apretude®) ou associado à rilpevirina, um inibidor não-nucleosídico da transcriptase reversa (Cabenuva®).
Em geral, o uso injetável é precedido de um período de adaptação com o fármaco por via oral, para avaliar a tolerabilidade pelo paciente. As primeiras duas injeções são espaçadas por 1 mês, para garantir o acúmulo do fármaco e obtenção de níveis plasmáticos adequados para o efeito terapêutico. As demais administrações podem ser feitas a cada 2 meses, na maioria dos casos.
Atualmente, existem 55 estudos clínicos registrados com o cabotegravir, todos eles relacionados ao HIV (embora alguns avaliem adicionalmente outras situações, como hepatite B). Vários dos resultados desses estudos já estão disponíveis. Os testes clínicos são numerosos, com desenhos experimentais rigorosos e número grande de participantes, somando evidências interessantes quanto ao uso do fármaco. A maioria desses estudos avalia(ou) a viabilidade do uso do fármaco como alternativa de longa duração para a Profilaxia pré-Exposição (PrEP) oral, embora outros usos sejam avaliados.
PrEP com regime injetável a cada 2 meses
Pouco tempo depois da disponibilização do Truvada® (tenofovir + entricitabina) como opção para PrEP oral, a perspectiva de desenvolvimento de fármacos com perfil cinético mais favorável (de longa duração) já era considerada. O cabotegravir parecia um candidato interessante, já que suas formulações de liberação controlada causavam um pico plasmático em 7 dias e concentrações mantidas por até 8 semanas. Vários estudos clínicos com populações heterogêneas confirmaram a segurança e eficácia dessa preparação como PrEP, o que substanciou a aprovação desse uso nos EUA.
Um dos estudos que recebeu destaque foi o HPTN 083 (NCT02720094), no qual foram incluídos 4.566 homens cisgênero ou mulheres transexuais, sem HIV, que se relacionavam sexualmente com homens e apresentavam comportamentos de risco para a infecção pelo vírus. O estudo de fase 2/3 foi randomizado e quádruplo-cego, com o propósito de comparar a eficácia do uso intramuscular de cabotegravir (n=2.243) com a administração oral diária de Truvada® (n=2.247) como PrEP. Esse é um estudo de não-inferioridade, que compara o fármaco em estudo com um “controle positivo”.
Em 2020, 6 meses após o início do estudo, aconteceu a primeira avaliação preliminar programada. A análise dos dados demonstrou que a incidência de infecções por HIV foi 1,22 a cada 100 pessoas/ano com o uso da PrEP oral diária, em contraste com 0,41 a cada 100 pessoas/ano no grupo que recebeu o injetável. Ou seja, a formulação de longa duração foi associada a riscos até 3x menores de infecção por HIV.
O resultado foi tão importante e positivo que o estudo foi interrompido precocemente, já que o desfecho primário (não-inferiorioridade à PrEP oral) foi alcançado antes do previsto (obviamente, alguns meios de comunicação interpretaram a interrupção como um evento negativo, talvez por não entrarem nos detalhes sobre as motivações). O prosseguimento do estudo não seria ético, já que o grupo de participantes que recebia PrEP oral estava em maior risco de infecção pelo vírus. Os resultados foram publicados na New England Journal of Medicine no ano passado e foram cruciais para a aprovação do tratamento pelo FDA.
Um estudo mais recente, o HPTN 084 (NCT03164564), teve resultados publicados na The Lancet, nesse mês. Ele foi bastante parecido com o anterior, mas com a participação de mulheres cisgênero. Após um ano de tratamento, o estudo também foi interrompido por alcançar os critérios estabelecidos: a incidência de infecções por HIV foi 1,85 a cada 100 pessoas/ano com o uso da PrEP oral diária (n=1.586), em contraste com 0,2 a cada 100 pessoas/ano no grupo que recebeu o injetável (n=1.592). Nesse caso, o risco de infecção por HIV era mais de 9x maior com o uso da PrEP oral, confirmando os achados anteriores em outro recorte populacional.
O perfil de efeitos indesejados foi comparável nos 2 estudos, com poucas complicações sistêmicas e reações locais frequentes frente à administração do medicamento injetável (dor, desconforto, etc.). Desdobramentos desses estudos vem sendo realizados, incluindo a avaliação em adolescentes do sexo masculino (NCT04692077) ou feminino (NCT04824131).
Manejo terapêutico da carga viral de HIV com antivirais injetáveis
Cabenuva®, medicamento com suspensão de cabotegravir e rilpivirina de liberação controlada, da ViiV Healthcare.
Além da alternativa interessante como PrEP, o uso de formulações de longa duração pode revolucionar o tratamento de pessoas que vivem com HIV. Recentemente, resultados de 3 estudos clínicos nesse sentido (NCT02938520, NCT02951052, NCT03299049) foram compilados e publicados na BMC Infectious Diseases. Foram incluídos participantes com infecção ativa por HIV-1, mas com carga viral indetectável (< 50 cópias virais/mL de sangue) pelo tratamento prévio. Foram comparados o uso diário de terapia antirretroviral convencional (2 inibidores nucleosídicos da transcriptase reversa + 1 antiviral de outra classe) por via oral com o uso de cabotegravir + rilpivirina injetável (Cabenuva®) mensal ou a cada 2 meses.
Após 48 semanas de tratamento, os resultados demonstraram que o uso de injetáveis foi igualmente eficiente quando comparado ao tratamento oral diário. A manutenção da carga viral indetectável, contagem de células brancas e incidência de efeitos colatarais não foram diferentes entre os grupos avaliados. Ainda, a injeção intramuscular a cada 2 meses foi tão eficaz quanto o uso mensal, tornando possível a adoção de um protocolo de controle de infecções por HIV com 6 injeções/ano.
Com base nesses resultados, o FDA aprovou o uso mensal da preparação injetável no manejo de pacientes com HIV, em janeiro desse ano.
Perspectiva de implementação de injetáveis anti-HIV no SUS
A aprovação das preparações injetáveis para diversos fins nos EUA sinaliza a perspectiva de aprovação pela ANVISA. A Fundação Oswaldo Cruz (FIOCRUZ) está envolvida com um estudo de avaliação da viabilidade em implementar a PrEP injetável no contexto brasileiro, via SUS. A possibilidade de disponibilização futura de uma alternativa mais cômoda e que otimize a adesão ao tratamento pode melhorar os indicativos de efetividade da PrEP no Brasil.
A implementação do uso de injetáveis no tratamento continuado de pacientes que vivem com HIV ainda não é previsto no país.
PS: os nomes comerciais utilizados ao longo do texto são patenteados internacionalmente. Nenhum medicamento contendo cabotegravir e/ou rilpivirina tem registro no Brasil atualmente, portanto seus nomes-fantasia podem ser diferentes no país.

