Novo medicamento da Pfizer reduz 90% das internações por COVID-19
 Após um mês do anúncio do molnupiravir como nova alternativa no tratamento da COVID-19 pela Merck, resultados do desenvolvimento de outras estratégias terapêuticas foram anunciadas. O PAXLOVID™, medicamento contendo uma combinação de antivirais, reduziu drasticamente a chance de hospitalização em pacientes de alto risco. O anúncio foi feito pela Pfizer, farmacêutica responsável pelo novo medicamento, em 5 de novembro de 2021.
Após um mês do anúncio do molnupiravir como nova alternativa no tratamento da COVID-19 pela Merck, resultados do desenvolvimento de outras estratégias terapêuticas foram anunciadas. O PAXLOVID™, medicamento contendo uma combinação de antivirais, reduziu drasticamente a chance de hospitalização em pacientes de alto risco. O anúncio foi feito pela Pfizer, farmacêutica responsável pelo novo medicamento, em 5 de novembro de 2021.
PF-07321332 e a composição do PAXLOVID™

Estrutura do PF-07321332, antiviral presente no PAXLOVID™.
O antiviral experimental PF-07321332 foi desenvolvido pela Pfizer em meados dos anos 2000, em uma tentativa de encontrar uma solução terapêutica para a Síndrome Respiratória Aguda Severa, a SARS. Com a chegada da COVID-19, que é causada por um vírus relacionado ao causador da SARS, as pesquisas com o PF-07321332 foram retomadas, incluindo melhorias estruturais que permitem administração oral e maior biodisponibilidade.
O fármaco tem ação inibidora da protease viral SARS-CoV-2-3CL (3-chymotrypsin-like protease), que impediriam a proliferação do coronavírus em células humanas. A proteólise é uma etapa importante para a replicação de RNA viral e produção de novos vírus, processo necessário para a progressão da doença. Esse efeito parece acontecer sem a indução de mutagênese viral, minimizando os riscos de surgimento de novas variantes em pacientes expostos ao tratamento (com o surgimento recente da variante ômicron, essa informação é especialmente importante).
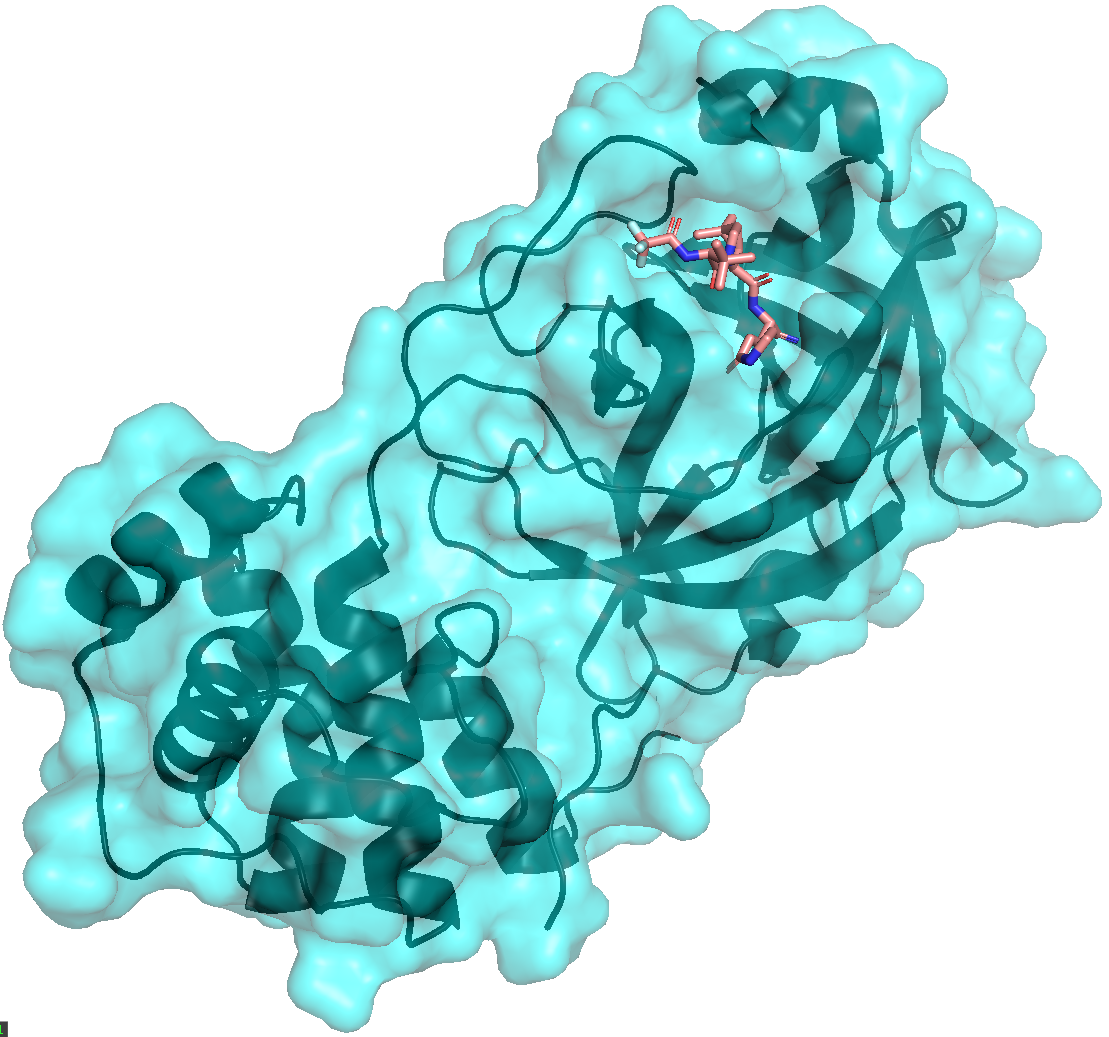
Estrutura tridimensional da protease do coronavírus, SARS-CoV-2-3CL (em tons de azul), e local de interação do PF-07321332 (em rosa).
O PAXLOVID™, contudo, é uma combinação do PF-07321332 com o ritonavir, que também é um antiviral inibidor de proteases, mas utilizado atualmente no controle da carga viral em pacientes com HIV. O ritonavir teve sua eficácia contra COVID-19 avaliada durante a pandemia, mas com resultados pouco encorajadores que levaram à recomendações contra seu uso (tanto pelo NIH quanto pela OMS). Mesmo assim, sua presença no PAXLOVID™ é justificada por seus efeitos farmacocinéticos: ele é um inibidor potente das enzimas do citocromo P450, especialmente a isoforma 3A, impactando no metabolismo de outros fármacos. Por isso, mesmo em dose baixa, o ritonavir reduz o metabolismo e mantém concentrações plasmáticas maiores do PF-07321332 por mais tempo, otimizando o regime terapêutico do PAXLOVID™.
Estudos clínicos com o PAXLOVID
Após confirmação do perfil de segurança em pacientes saudáveis em estudos de fase 1, a Pfizer iniciou estudos clínicos de segurança e eficácia em pacientes com COVID-19 em Julho de 2021. O estudo combinado de fases 2 e 3 em pacientes não-hospitalizados e de risco alto para progressão da doença foi batizado de EPIC-HR (Evaluation of Protease Inhibition for COVID-19 in High-Risk Patients). O estudo é duplo-cego, randomizado e multicêntrico (em 5 continentes), com final previsto para Abril de 2022 (NCT04960202).
A avaliação preliminar foi feita com os resultados de 1219 participantes incluídos no estudo até final de Setembro. Os pacientes com diagnóstico recente de COVID-19 e fatores de risco para desenvolvimento de quadros severos da doença receberam placebo ou PAXLOVID™ durante 5 dias, a cada 12h, por via oral.
Houve quase 90% de redução no risco de hospitalizações por COVID-19 ao longo de 28 dias em pacientes que iniciaram o tratamento nos primeiros 3 dias após a detecção da doença, em comparação ao placebo (0,8% vs. 7%, respectivamente). Quando o tratamento foi iniciado em até 5 dias após o início dos sintomas, também houve redução significativa nas hospitalizações (1% vs. 6,7%). Nenhuma morte foi relatada no grupo que recebeu o tratamento, com incidência de 1,6% no grupo placebo. A ocorrência de sintomas indesejados foi similar entre os grupos avaliados.
Após os dados preliminares positivos, o Comitê de Monitoração de Dados (independente, vinculado ao FDA) recomendou a finalização de recrutamentos e início do processo de registro para uso emergencial. Em 16 de Novembro de 2021, a Pfizer fez a solicitação de uso emergencial junto ao FDA. Novos estudos, voltados à avaliação de eficácia em pacientes com risco padrão de progressão da COVID-19 (Evaluation of Protease Inhibition for COVID-19 in Standard-Risk Patients; EPIC-SR, NCT05011513) e para profilaxia pós-exposição ao vírus (Evaluation of Protease Inhibition for COVID-19 in Post-Exposure Prophylaxis; EPIC-PEP, NCT05047601), devem expandir a possibilidade de uso do fármaco em outras situações.
Acesso do PAXLOVID™ no mundo e perspectivas
Os EUA já fecharam um acordo de U$5,29 bilhões com a farmacêutica para garantir o acesso a 10 milhões de tratamentos, com entrega a partir desse ano. O custo estimado para cada tratamento (10 comprimidos, 2 por dia durante 5 dias) é entre U$300 a U$700. A Pfizer, no entanto, assumiu um compromisso de oferecer o medicamento a preços variáveis, de acordo com o nível de desenvolvimento econômico de cada país. Opções de fabricação e distribuição em vários países também foi mencionado, como forma de reduzir os custos do tratamento e aumentar o acesso no mundo. A farmacêutica assinou compromisso com a Medicines Patent Pool (MPP), um grupo das Organização das Nações Unidas, que estimula e facilita a concessão para fabricação de genéricos em mais de 95 países, cobrindo até 53% da população mundial.
Se aprovado, o medicamento pode ser o primeiro “tratamento precoce” – idealmente nos primeiros 5 de detecção da doença – com evidências suficientes para justificar seu uso.
Informações completas podem ser encontradas no anúncio feito pela Pfizer.
