Nova opção para tratamento da Leishmaniose disponibilizada na rede pública

(Texto de autoria de Marli Marques, Doutora em Doenças Infecciosas e Parasitárias e Docente do Programa de Pós-graduação em Saúde da Família/INISA/UFMS)
A miltefosina, uma das opções mais recentes para o manejo da Leishmaniose, passou a ser fornecida, em 2021, pelo Ministério da Saúde para estados e municípios, restrito a serviços de referência para leishmaniose, visto a necessidade de controle especial e cuidados relacionados a prescrição, dispensação e acompanhamento no seu uso.
A disponibilização acontece após a Portaria n° 56, de 30 de outubro de 2018, que tornou pública a decisão de incorporar a miltefosina como primeira linha para o tratamento da Leishmaniose no âmbito do Sistema Único de Saúde (SUS).
A Leishmaniose como doença de importância global
A leishmaniose é uma doença infecciosa, não contagiosa, causadas por protozoários do gênero Leishmania, transmitidas por mosquitos flebotomíneos (“mosquito-palha”). Apresenta-se de forma endêmica no Brasil e é considerada doença negligenciada. Essa classificação se dá por atingir grupos populacionais mais pobres ou desassistidos da atenção à saúde e pelos escassos investimentos em pesquisas, desenvolvimento, inovação e produção de medicamentos para o tratamento e controle.
A Leishmaniose Tegumentar (LT) envolve o parasitismo das células do sistema fagocítico mononuclear (sistema imune) da pele e das mucosas do hospedeiro vertebrado (no caso, o humano) que se manifesta provocando úlceras na pele e/ou mucosas, podendo causar deformidades quando não tratadas ou com tratamento incompleto. A Organização Panamericana de Saúde (OPAS) recebeu registros de 41.617 casos novos de LT na região das Américas em 2019, com aproximadamente 77% desses casos ocorridos em 5 países, sendo eles: Brasil (37,2%), Colômbia (14,2%), Peru (12,9%), Nicarágua (7,8%) e Bolívia (4,9%) representando um importante problema de saúde pública, especialmente no contexto brasileiro.
Leishmanioses no Brasil
No país, as ações de controle visam reduzir a morbidade e mortalidade, fortalecendo o diagnóstico, tratamento, reabilitação, prevenção, vigilância e controle. Especificamente até 2022, as autoridades em saúde pública almejam reduzir as mortes em 90% e os registros em crianças menores de 10 anos em 50%. Para atingir essas metas, é necessário que cada gestor de saúde identifique a ocorrência da doença no seu território e ofereça assistência aos acometidos evitando sequelas e óbitos, desenvolva ações para conhecer áreas de risco e direcione o controle de mosquitos e ações de educação em saúde para essas áreas.
No Brasil, focos de transmissão da LT que eram restritos a zona de mata, mas hoje são identificados nas periferias das grandes cidades, incluindo áreas centrais urbanas de municípios de médio e grande porte, em decorrência da urbanização crescente, com modificações no perfil dos casos, acometendo mulheres e crianças no peridomicílio.
No Mato Grosso do Sul no período de 2016-2018 foram registrados 223 casos novos da LT, 9 casos em menores de 10 anos (4,0%), 56 em idosos acima de 60 anos (25,1%) onde 5 nesse grupo etário evoluíram para óbito (8,9%) (dados do DATASUS), no qual 28 municípios apresentaram risco de transmissão muito alto.
Estes dados mostram a magnitude da doença em nosso meio, especialmente para crianças e idosos cuja imunidade se encontra deficitária, além do agravamento relacionado aos efeitos indesejados dos fármacos entre idosos com comorbidades.
Arsenal terapêutico clássico: opções velhas com problemas conhecidos
Em uso há mais de 60 anos no país, o antimoniato de meglumina (Glucantime®) é o fármaco considerado, até então, de primeira escolha para o tratamento da LT. Ele atua interferindo na bioenergética das formas amastigotas de do protozoário, atuando na glicólise e na oxidação dos ácidos graxos. Um problema importante é que essa ação não é exclusiva nos parasitos e também acontece nas células dos mamíferos, que apresentam menor sensibilidade à ação da enzima fosfofrutoquinase.
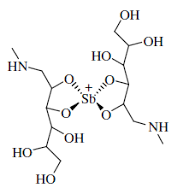
O antimoniato de meglumina tem um átomo de estibônio (Sb) pentavalente, também chamado de antimônio, em sua estrutura.
O Glucantime® é fornecido em ampolas de 5 mL contendo 300 mg/mL de antimoniais de meglumina (AM), teoricamente equivalente a uma concentração de princípio ativo Sb5 (estibônio ou antimônio) de 81 mg/mL e uma dose total de 405 mg de Sb5 por ampola. O regime terapêutico para adultos e crianças varia de 10 a 20 mg Sb5/kg/dia administrado por 20 a 30 dias consecutivos por via intravenosa (EV) ou intramuscular (IM), e novo regime de tratamento, se necessário.
Mesmo sendo bem tolerado, este fármaco apresenta efeitos indesejados, incluindo alterações gastrintestinal, dores musculares difusas, enrijecimento das articulações, arritmias, pancreatite e elevação das transaminases hepáticas (indicativo de sobrecarga e/ou lesão). Também pode ocorrer resistência do parasita, seja por tratamento insuficiente ou pelo abandono, que ocorre em função do difícil acesso aos serviços que realizam o tratamento parenteral (IM ou EV) preferencialmente endovenoso, em serviços de referência com profissionais treinados. A administração exclusivamente parenteral também é um fator importante na baixa adesão ao tratamento.
O uso do Glucantime como terapia intralesional (subcutânea), que passou a ser recomendado pela OPAS a partir de 2013 e adotada pelo Ministério da Saúde desde 2017, é restrito para forma cutânea localizada e leishmaniose recidiva cútis, (exceto a causada pela L. guyanensis), com até 3 cm de diâmetro, em qualquer região anatômica, exceto cabeça e regiões periarticulares. Esta forma de administração é pouco utilizada em nosso meio, provavelmente por falta de treinamento dos profissionais, e o tratamento pode se estender até 120 dias, considerando os retornos para reaplicação quinzenais.
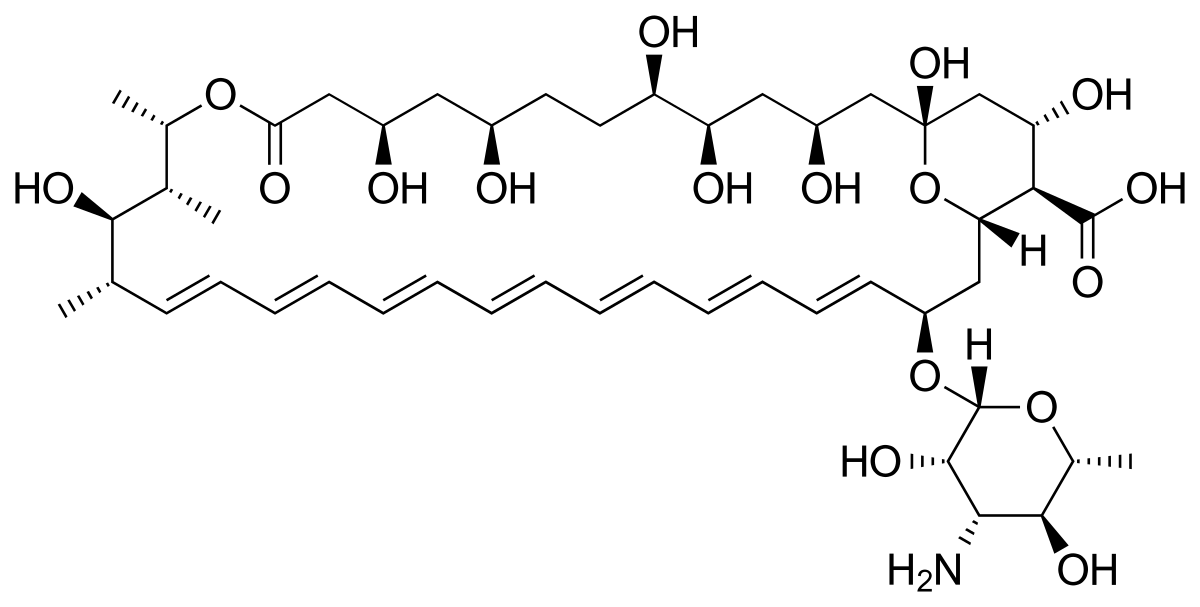
A Anfotericina B tem estrutura complexa e polar, que dificulta o uso oral.
A Anfotericina B lipossomal, antibiótico macrolídeo poliênico, é a droga de segunda escolha no tratamento, empregada quando não se obtém resposta ao tratamento com antimonial ou na impossibilidade de seu uso. Os efeitos indesejados mais frequentes são febre, náuseas, vômitos, hipopotassemia e flebite no local da infusão, e não está indicada para cardiopatas, hepatopatas e nefropatas. O custo do tratamento é altíssimo e requer administração parenteral, o que também limita o acesso e adesão ao tratamento.
Miltefosina: uma nova opção disponibilizada na rede pública
A inclusão da miltefosina no arsenal terapêutico disponibilizado gratuitamente cria novas pespectivas para o tratamento da Leishmaniose no Brasil. O fármaco age inibindo a biossíntese de fosfolípides e esteróis na membrana celular do parasita, interferindo nas vias celulares de sinalização e na permeabilidade da membrana, causando morte celular por apoptose em promastigotas e amastigotas de várias espécies de Leishmania.
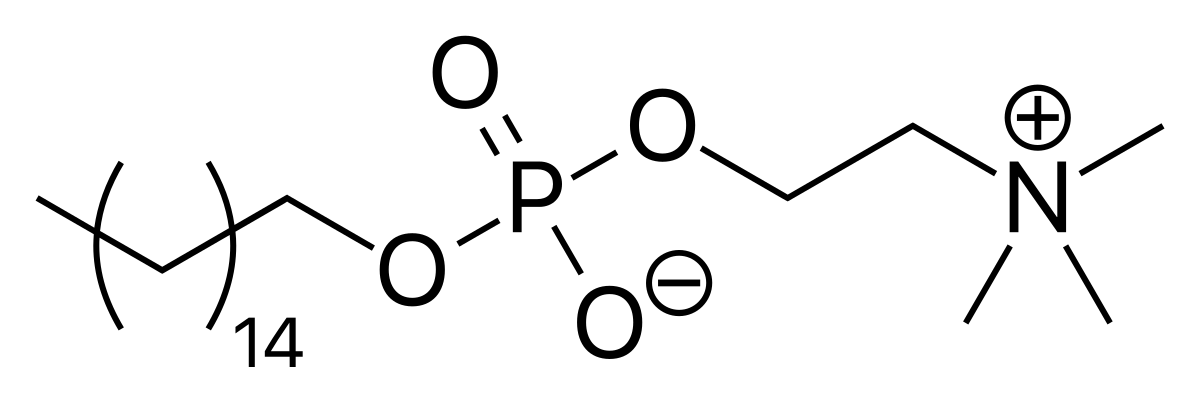
A miltefosina tem uma longa cadeia carbônica e grupo fosfato, podendo atuar mimetizando a estrutura de fosfolipídeos de membrana.
Uma grande vantagem dessa droga é a possibilidade de administração oral, o que aumenta a comodidade do tratamento e, consequentemente, a adesão do paciente. A recomendação é que seja feita a administração de 2,5 mg/kg/dia, por via oral, dividida em 2 a 3 doses por dia, até o limite de 150 mg/dia (3 cápsulas/dia).
Após a ingestão oral, a miltefosina é lentamente absorvida pelo trato gastrointestinal, com meia-vida média, em adultos e crianças, de 1 semana. A distribuição tecidual é ampla, principalmente para rins, mucosa intestinal, fígado, pulmão e baço. A miltefosina não interage com as enzimas metabólicas da via citocromo P450, sendo metabolizada pela fosfolipase C com liberação de colina, o que reduz a incidência de interações medicamentosas. Apenas 0,2% da droga é eliminada por via renal sem ser metabolizada. As reações indesejadas mais comuns são náuseas, vômitos e diarreia, consideradas leves e transitórias na maioria dos casos. Outras reações menos frequentes incluem tontura, cefaleia, sonolência, inapetência e epigastralgia.
A miltefosina tem contraindicação absoluta a pacientes que apresentem hipersensibilidade à substância ativa ou a qualquer dos excipientes; danos graves e pré-existentes da função hepática ou renal; Síndrome de Sjogren-Larsson; problemas hereditários raros de intolerância à galactose, deficiência de lactase ou má absorção de glucose-galactase; e gravidez (risco de teratogenia e malformações fetais).
Limitações dos tratamentos
As dificuldades listadas com os três fármacos disponíveis para tratamento de pacientes infectados pelas diferentes espécies de Leishmanias (exceto L. guyanensis, não identificada em Mato Grosso do Sul) dizem respeito à possibilidade de não obter a almejada cura, que é reconhecida através do exame clínico ao final do tratamento proposto, e seguimento do paciente por um ano sem sinais de reativação da doença.
Os desafios para obter a cura devem servir de estímulo aos pesquisadores para a busca por novas substâncias com ação leishmanicida, assim como fórmulas farmacêuticas mais fáceis de administrar, melhor toleradas pelo organismo humano e com pouco risco teratogênico.
Esta busca deve considerar as diferentes formas de manifestação da doença, que exige diferentes mecanismos farmacocinéticos e farmacodinâmicos das drogas utilizadas; a grande variabilidade da sensibilidade das drogas nas diferentes espécies de Leishmania conhecidas que infectam o homem; diferenças metabólicas entre promastigotas e amastigotas, o que requer estudos mais aprofundados e associações entre as diversas áreas do conhecimento para o desenvolvimento e/ou melhoramento dos fármacos.
A busca por novos agentes leishmanicidas
Os pesquisadores podem lançar mão de novos protótipos farmacêuticos encontrados principalmente em produtos de origem natural a fim de desenvolver novos fármacos. O estudo biomonitorado favorece um isolamento mais rápido e eficaz de compostos ativos, permitindo a introdução de modificações químicas nestes protótipos naturais com o objetivo de amplificar sua atividade específica ou reduzir seu efeito tóxico.
Estudos no país com produtos naturais sinalizam o potencial de substâncias e óleos como a benzofenonas preniladas isoladas de Garcinia brasiliensis e também em óleo de copaíba extraído de diferentes espécies do gênero Copaifera, além da necessidade de continuidade de estudos com a Kalanchoe pinnata que apresenta flavonoides com atividade leishmanicida.
Apesar da literatura dispor de uma diversidade de produtos naturais ou sintéticos que mostram atividade inibitória contra Leishmania em sistemas in vitro, poucos estudos avançam até a fase in vivo e clínicos, que têm a função de acumular dados sobre a resposta do corpo humano ao novo medicamento. Isso pode acontecer por vários motivos, incluindo desde um perfil de toxicidade significativo, perfil farmacocinético inadequado ou falta de financiamento/interesse da indústria farmacêutica.
A falta de priorização para a área da ciência e tecnologia no país vem comprometendo drasticamente a produção de conhecimento e a possibilidade de desenvolvimento ou continuidade de pesquisas na busca de novas substâncias para fins terapêuticos, a despeito da biodiversidade brasileira ser a maior do mundo.
A exemplo do que ocorreu com a descoberta do primeiro inseticida em nível mundial, extraído de plantas do Cerrado, que mata o Aedes aegypti adulto, a larva e ovos, preservando outros serem vivos onde as diferentes fases do inseto se encontram, enobrece tais pesquisadores e mostra o potencial de brasileiros na busca de novos fármacos para outros doenças tropicais negligenciadas como é o caso das Leishmanioses, que carecem de medicamentos mais eficazes, menos tóxicos e sem riscos aos que inadvertidamente possam fazer uso.
